素有“生命必需分子”之称的烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+)是一种存在于所有活细胞中的关键物质,机体的各项生命活动都要依靠它。若将人体看作是汽车,NAD+就是这辆车的汽油。新车性能好,省油跑的快;但随着年龄增长,新车变旧,耗能上升,NAD+含量严重下降,导致机体出现各种故障问题。尽管现有多种手段(如口服NAD+前体NMN)可以及时补充NAD+,但如果不找出汽车废油的根本问题,那这无疑是治标不治本。
近期,来自美国明尼苏达州(Minnesota)罗切斯特市梅奥医学中心(Mayo Clinic in Rochester)的Chini及其同事为“汽车费油”找到了关键原因,即一种存在于免疫细胞膜表面上的CD38蛋白可能大量消耗了机体内的NAD+。目前该研究团队已在《自然代谢》(Nature Metabolism)杂志上发表该研究 [1],表明在衰老过程中,慢性炎症的增加会刺激M1巨噬细胞(一种免疫细胞类型)来表达CD38,而CD38的积累会导致NAD+及其前体NMN含量显著下降。
免疫细胞膜上的CD38参与NAD+的下降过程
CD38是一种位于细胞膜表面的代谢酶(参与代谢的蛋白质),于1980年被E.L. Reinherz等科学家发现,虽然其主要功能暂未完全清晰,但最近越来越多的研究发现,CD38可能与机体的免疫调节、衰老细胞中NAD+的含量密切相关。然而,一些具体的关键性问题,如在衰老期间哪些细胞会产生CD38,CD38含量增加的具体原因,以及CD38在调节NAD+及其前体NMN含量方面发挥的作用等均有待研究证实。
衰老组织中可分泌CD38蛋白的免疫细胞显著增多
衰老一直被认为是一种慢性持续的炎症状态,而CD38主要分泌于多种免疫细胞的表面,因此Chini等人猜测,分泌CD38的免疫细胞(CD38+)总数量可能会随着衰老而增加。对此,Chini等人利用免疫组化和流式细胞术,比较了年轻鼠(3-4月龄)和年老鼠(28-32月龄)的白色脂肪组织和肝脏中与CD38蛋白分泌相关免疫细胞的含量变化。
结果表明,与年轻鼠相比,年老鼠的白色脂肪组织和肝脏中可表达CD38蛋白的免疫细胞总数量显著增加(如图1),初步证实了Chini等人的猜测。
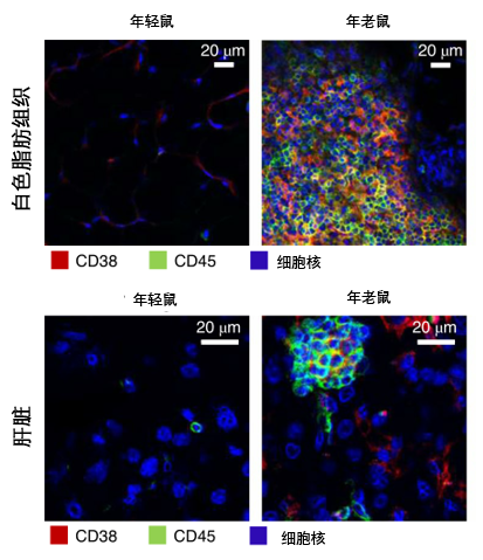
其中红色代表分泌CD38的免疫细胞,绿色代表分泌CD45(可作为某些免疫T细胞亚群的分类标志)的免疫细胞,蓝色代表细胞核。
促炎细胞(M1巨噬细胞)中CD38蛋白的活性飙升
Chini等人虽证实了衰老组织中可分泌CD38蛋白的免疫细胞显著增多,但具体是哪一类细胞主要分泌了CD38尚不清楚。对此,Chini等人进一步分离了免疫细胞群,分别检测了各种类型的免疫细胞中CD38的含量。
结果表明,M1巨噬细胞(可促进炎症的发生发展)、T细胞和自然杀伤细胞都可分泌CD38 (如图2),但M1巨噬细胞的活性最高,这也提示,CD38或许与炎症相关。
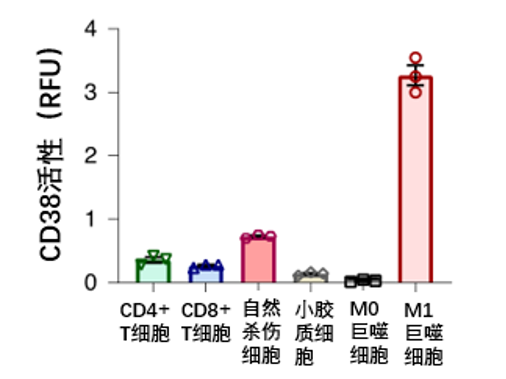
其中CD4+和CD8+都是T细胞的亚型。
慢性炎症显著加剧CD38蛋白对NAD+和NMN的消耗
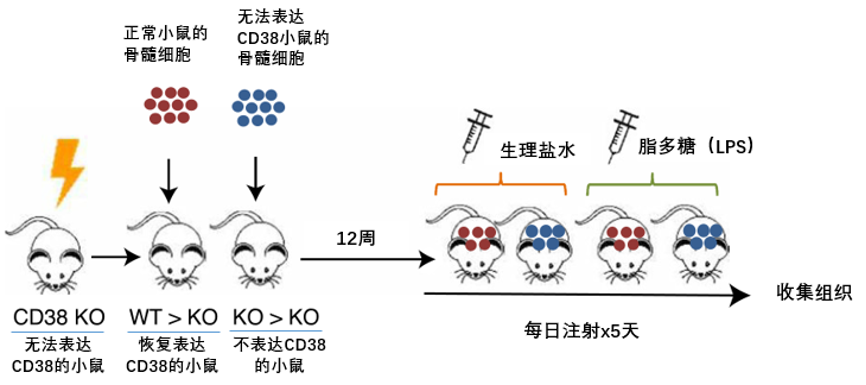
为了确定CD38蛋白对NAD+和NMN的含量有何种影响,Chini等人进行了小鼠之间骨髓移植实验。实验将正常小鼠的骨髓转移到无法表达CD38的基因改造小鼠体内,因为正常小鼠的骨髓中含有的干细胞,可使无法表达CD38的转基因小鼠恢复CD38的正常表达。骨髓移植后的小鼠继续培养12周后,注射一种称为脂多糖的炎症诱导分子来诱导炎症状态,通过检测白色脂肪细胞中的NAD+和其前体β-烟酰胺单核苷酸(Nicotinamide mononucleotide,NMN)的含量,来观察CD38和慢性炎症对NAD+稳态的影响(图3)。
结果如图4所示,1)相比无法表达CD38蛋白的小鼠来说,正常表达CD38蛋白小鼠的白色脂肪组织中,NAD+和NMN含量均发生显著降低;2)脂多糖诱导的炎症显著降低了白色脂肪组织中NAD+和NMN的含量,且在正常表达CD38蛋白的小鼠中,炎症加剧了NAD+和NMN含量的下降,这说明炎症可显著增加CD38对NAD+和NMN的消耗。

其中,WT>KO代表将正常小鼠骨髓转移到没有CD38蛋白的小鼠,KO>KO代表无法表达CD38蛋白小鼠,WT>KO+LPS代表将正常小鼠骨髓转移到没有CD38蛋白的小鼠并注射脂多糖,KO>KO+LPS代表无法表达CD38蛋白小鼠注射脂多糖。
CD38蛋白通过消耗NMN来调节NAD+含量
上述结果虽说明了CD38蛋白对NAD+的影响,但难以解释的是NAD+作为一种细胞内物质,细胞外膜上CD38蛋白究竟是如何进行调节的。对此,Chini等人将目光聚焦到了NMN上,作为NAD+的直接前体物质,其含量的变化直接影响细胞内NAD+的含量。因此,Chini等人分别将细胞和动物作为研究对象,从微观和宏观两个角度探究了CD38蛋白对NMN(直接)和NAD+(间接)的影响。
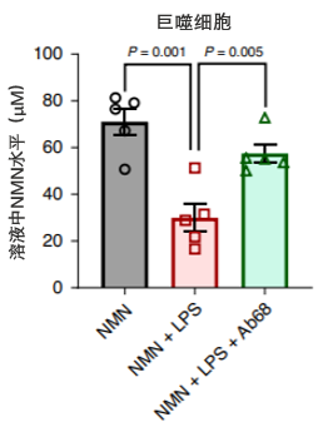
在细胞层面上,Chini等人先用脂多糖诱导M1巨噬细胞产生炎症反应,然后再添加NMN或NMN+Ab68(CD38蛋白抑制剂),并测定细胞溶液中NMN的含量。
结果显示,脂多糖处理后,巨噬细胞溶液中NMN的含量降低,但这种效果被CD38蛋白抑制剂Ab68逆转。这些结果表明炎症诱导M1巨噬细胞产生的CD38蛋白消耗了溶液中的NMN含量(图5)。
在动物试验中,研究者分别在年轻鼠和年老鼠中给予Ab68、NMN或Ab68+NMN,随后检测白色脂肪组织中NAD+含量的变化情况。结果发现,与对照组(Ctrl)相比,无论年轻鼠或年老鼠,施用Ab68后组织中NAD+含量均有提高。并且在年老鼠中,与对照组(Ctrl)相比,仅补充NMN可提高NAD+含量约20倍,但当同时补充NMN和Ab68时,NAD+含量有更显著的提高,可提高至约30倍。这也印证了上述研究结论,即与年轻鼠相比,年老鼠因机体衰老引起的慢性炎症,会刺激免疫细胞,产生更多的CD38蛋白,对应也消耗了更多的NMN和NAD+含量;而抑制CD38蛋白后,NMN提高NAD+含量的幅度也更强。
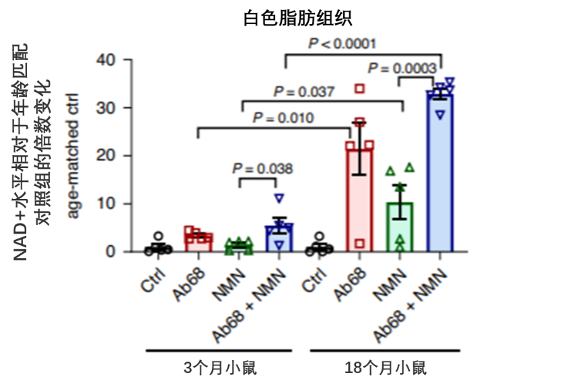
综上所述,在衰老过程中,慢性炎症的增加会刺激机体免疫细胞中M1巨噬细胞分泌更多的CD38蛋白,而当CD38蛋白积累后则会消耗大量NMN而导致NAD+含量显著下降。
Chini等人的研究揭示了衰老、免疫细胞、CD38 蛋白和NAD+这几者之间的关联,是探索NAD+随年龄减少相关机制的重要进展。该团队不仅发现并强调了衰老细胞在引起免疫细胞表面CD38蛋白积累中起着关键作用,还从侧面解释了年龄增长导致体内NAD+含量下降的可能原因之一,这也为抑衰之路打开了新思路。试想如果可以从“开源—及时补充”和“节流—减少消耗”两个角度共同解决NAD+下降问题,或许衰老可以更晚一点来。但科学家们也提到, NAD+遍布所有细胞中,其复杂的生理功能和涉及的通路途径,仍需要更多的研究来探索,这样才能让人们更透彻地理解NAD+在衰老中的作用。